METABOLISMO DE AMINOÁCIDOS Y PROTEÍNAS
En el metabolismo de las proteínas se incluyen aquellos
procesos que regulan la digestión de las proteínas, el metabolismo de los
aminoácidos y el turnover de las proteínas; procesos que a su vez incluyen la
absorción y suministro de aminoácidos de la dieta, la síntesis de novo y
utilización de aminoácidos y la hidrólisis y síntesis de proteínas. Las
proteínas, al contrario que otras biomoléculas, no se almacenan. Todos los
aminoácidos, ya sean de la dieta como derivados del turnover, se degradan. Los
aminoácidos se metabolizan mediante la escisión, por un lado de su esqueleto
carbonado y por otro lado del grupo amino, este último se eliminará en forma de
urea.
DIGESTIÓN DE LAS PROTEÍNAS
La digestión de las proteínas comienza en el estómago, donde
serán atacadas por la enzima pepsina, y se completa en el duodeno y yeyuno. El
jugo pancreático, junto con las enzimas que contienen las células intestinales,
transformarán el contenido proteico en estructuras más simples. Estas pasarán a
través de la mucosa intestinal hasta llegar a los enterocitos donde se
completará la hidrólisis, obteniendo así aminoácidos y, en una menor cantidad,
oligopéptidos.
 El metabolismo proteico en hígado y músculo, al contrario
que en el enterocito, está sujeto a control hormonal. Los aminoácidos llegan al
hígado por la vena porta, donde parte de ellos podrán ser liberados a la
circulación sistémica y otros utilizados para la síntesis de proteínas (como
albumina, transferrina, fibrinógeno etc.)
El metabolismo proteico en hígado y músculo, al contrario
que en el enterocito, está sujeto a control hormonal. Los aminoácidos llegan al
hígado por la vena porta, donde parte de ellos podrán ser liberados a la
circulación sistémica y otros utilizados para la síntesis de proteínas (como
albumina, transferrina, fibrinógeno etc.)
ENZIMAS
INVOLUCRADAS
HIDRÓLISIS DE PROTEÍNAS POR ACCIÓN DE LA PEPSINA.
En el mismo estómago el HCL encargado de la
desnaturalización de las proteínas activa la producción la producción de
pepsinógeno a través de la célula principal al detectar un PH ácido ya que es
cuando mejor actúa . El pepsinógeno es una proenzima sin actividad
biológica, necesita activarse en enzima para poder realizar su función de
hidrólisis de proteínas. Aquí es donde entra el HCL, que transforma el inactivo
pepsinógeno en su forma activa: pepsina. La pepsina es una enzima digestiva de
la familia de las proteasas que se encarga de hidrolizar las proteínas en el
estómago. La hidrólisis de proteínas consiste en romper los enlaces peptídicos
entre aminoácidos por acción del agua. Recordemos que una proteína esta formada
por un conjunto de aminoácidos unidos por enlaces peptídicos. Esta proteasa
utiliza H2O para romper los enlaces péptidos de la proteína. La pepsina
hidroliza un 20% del total de las proteínas que ingerimos. La pepsina rompe las
uniones peptídicas de fenilalanina y tirosina
HIDRÓLISIS DE
PROTEÍNAS POR ACCIÓN DE LAS ENZIMAS PANCREÁTICAS.
Después de varias horas de digestión en el estómago se forma
el quimo, una masa ácida donde las proteínas ingeridas se han transformado en
elementos más pequeños, que a través de los movimientos peristálticos del
estómago van a pasar hacia el intestino de forma regular. El mismo intestino va
a ser el encargado de estimular al páncreas en la secreción de enzimas
proteolíticas terminando así la degradación total de las proteínas.
Recordemos que el quimo al ser una mezcla de alimentos, HCL
y proteasas posee un PH ácido que puede dañar al duodeno si no lo neutraliza.
Aquí es donde el páncreas va a realizar dos funciones muy importantes:
- Secretar enzimas proteolíticas para terminar con la degradación total de proteínas. El estómago solo hidroliza un 20% y es aquí, a través del jugo pancreático donde se va a producir el otro 80% de hidrólisis proteica.
- Segregar iones HCO3- que neutralicen el quimo ácido evitando así una posible úlcera duodenal. Como vemos en la foto de la derecha, el duodeno está comunicado a con el páncreas y la vesícula biliar a través del conducto de Wirsung y colédoco que desembocan en el esfínter de Oddi.
ABSORCIÓN DE
La ingestión diaria de proteínas es de aproximadamente 70‑90
g, siendo sus fuentes principales la carne y los productos lácteos. Además de
la fuente dietética, una parte importante de las proteínas que llegan al
intestino proceden también de las secreciones digestivas (25%) o la descamación
de células epiteliales (25%).
La digestión de las proteínas se inicia por acción de la
pepsina del estómago, dando lugar a la formación de polipéptidos, oligopéptidos
y algunos aminoácidos. La digestión se continúa en el intestino gracias a las
proteasas del jugo pancreático (tripsina, quimotripsina, carboxipeptidasas,
colagenasa y elastasa), formándose ya oligopéptidos (30%) y diferentes
aminoácidos (70%).
Al igual que ocurría con los glúcidos, la digestión se
completa a nivel del borde en cepillo de las células intestinales o
enterocitos. Estos con tiene una serie de aminopeptidasas orientadas hacia el
exterior de la membrana, que hidrolizan la mayor parte de los péptidos,
liberando aminoácidos. Una pequeña parte de los péptidos pueden, no obstante,
pasar al interior de las células a través de un transportador ligado a H+ y se
hidrolizan a aminoácidos por medio de peptidasas citoplasmáticas. Los
mecanismos de absorción de los aminoácidos son transporte activo secundario
acoplado al sodio, existiendo cuatro tipos de transportadores distintos, para
los aminoácidos neutros, básicos, ácidos y uno específico para prolina e
hidroxiprolina.
La mayor parte de los productos de la digestión de las
proteínas se absorben en el intestino delgado. Al intestino grueso sólo llegan
pequeñas cantidades que serán catabolizadas por la flora intestinal. Es
importante señalar que, aunque en proporciones muy pequeñas, también es posible
la absorción intestinal de proteínas por mecanismos de pinocitosis. La
importancia nutritiva es mínima, pero sí puede tener interés al desencadenar
una respuesta inmunológica.
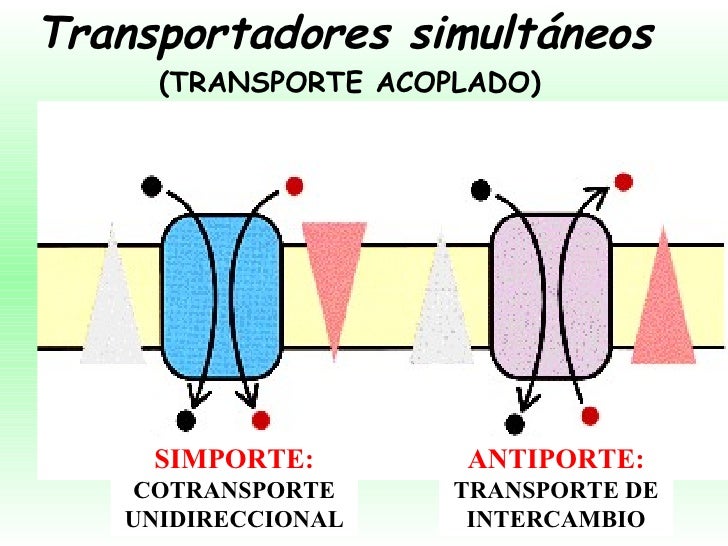
MECANISMO SIMPORTE
El transporte por medio de proteínas llamado simporte es
también llamado cotransporte, mueve un ion a favor de su gradiente de
concentración y otro en contra de su gradiente pero en el mismo sentido, este
transporte gasta un ATP de energía pero lo obtiene al momento en que mueve al
ion a favor de su gradiente. Este transporte es característico de varios
procesos fisiológicos muy importantes, especialmente en el epitelio absorbente
del intestino delgado y el túbulo renal. Ejemplo de este transporte es el
denominado SGLUT 1.
CICLO DEL Y-GLUTAMILO
Meister propuso un transporte de aminoácidos a través de la
membrana celular como dipéptidos del acido glutámico. El aspecto importante de este sistema de transporte es que
el glutatión (g-sh) sirve como donador de un grupo y-glutamilo que es
transferido al grupo amino del aminoácido seleccionado para el transporte.
RESERVA DE
Se entiende por reserva de aminoácidos a la cantidad total
de aminoácidos disponibles en el organismo humano. El tamaño de esta reserva en
un hombre adulto es de 120 a 130 gramos. Si tomamos las proteínas de la
alimentación éstas se descompondrán en el tracto gastrointestinal en
aminoácidos individuales y se unirán para convertirse en nuevas proteínas.
Estos complejos procesos bioquímicos se llaman síntesis de proteínas. De tres a
cuatro veces al día se renueva la reserva de aminoácidos – este proceso es
conocido coloquialmente como «intercambiar». El organismo por lo tanto, debe
añadir siempre nuevos aminoácidos, parcialmente a través de la biosíntesis de proteínas, en parte a través
de la dieta y en parte tomando suplementos dietéticos adecuados.
El objetivo es que la reserva de aminoácidos se mantenga
completamente en todo momento y en la combinación correcta. En el caso de que
no se encuentren a disposición del organismo uno o más aminoácidos en la
cantidad suficiente, entonces la formación de proteínas se debilitará y las
funciones del metabolismo podrían verse limitadas.
DIETA
La dieta proteica, también llamada hiperproteica o dieta de
las proteínas, se basa en un aumento del consumo de alimentos ricos en
proteínas como las carnes y los huevos, excluyendo alimentos ricos en
carbohidratos como el pan y la pasta. Ingerir más proteínas ayuda a disminuir
el hambre y aumentar la sensación de saciedad, esto ocurre debido a que actúa
sobre los niveles de grelina y otras hormonas que se encargan de regular el
apetito.
Asimismo, las proteínas podrían incrementar el metabolismo
ayudando a quemar más calorías y, la ausencia de carbohidratos en la
alimentación, haría con que el organismo utilice sus fuentes de grasa para
producir energía.
DEGRADACION PROTEICA(PROTEOLOSIS)
La degradación de las proteínas debe estudiarse
fundamentalmente a dos niveles dependiendo de la localización del proceso:
tracto digestivo:
Se procesan las proteínas exógenas o ingeridas de la dieta;
es la denominada digestión de proteínas.
Este proceso digestivo permite obtener los aminoácidos en
forma libre, necesarios para sintetizar las proteínas propias, así como otras
biomoléculas que se forman partir de ellos.
interior de la célula:
Se procesan las proteínas endógenas, lo que se suele conocer
bajo la denominación de recambio proteico.
Este recambio proteico es de gran utilidad para reciclar los
aminoácidos2 de proteínas que ya no son útiles para el organismo y generar
nuevas proteínas, u otras biomoléculas a partir de aminoácidos preexistentes.
Además, también sirve para la eliminación de aminoácidos
dañados.
LISOSOMA
El lisosoma es un tipo específico de orgánulo que es muy ácido.
Eso significa que tiene que ser protegido del resto del interior de la célula.
Es un compartimiento que tiene una membrana que lo rodea y que almacena las
enzimas digestivas, las cuales requieren de este ambiente ácido, con un pH
bajo. Esas enzimas se llaman enzimas hidrolíticas, y rompen las moléculas
grandes en moléculas pequeñas. Por ejemplo, proteínas de gran tamaño en
aminoácidos, hidratos de carbono de gran tamaño en azúcares simples, lípidos
grandes en ácidos grasos individuales. Y cuando lo hacen, proporcionan al resto
de la célula los nutrientes que necesita ... Así que, si usted no puede romper
las moléculas grandes en moléculas pequeñas, esas moléculas grandes se
acumularán y producirán una enfermedad. También hay otro tipo de enfermedad por
almacenamiento de lisosomas en la que las moléculas pequeñas que son producidos
a partir de las moléculas grandes no pueden salir del lisosoma. Se quedan
almacenadas allí porque los transportadores de estas pequeñas moléculas no se
producen debido a una alteración genética. Y, por último, otra función de los
lisosomas es la de ingerir bacterias, de modo que estas puedan ser destruidas.
Los lisosomas también ejercen una función contra la infección, ya que la célula
a menudo devora una bacteria y los lisosomas la destruyen. En resumen, se trata
de un orgánulo importante con una función contra las infecciones y que actúa de
tal modo en la alimentación que rompe las moléculas grandes en moléculas
pequeñas para que puedan ser reutilizados.
UBIQUITINA PROTEOSOMA
La ubiquitina proteosoma se encuentra implicada en el
recambio intracelular de las proteínas y juega un papel importante en la
degradación de proteínas reguladoras de vida corta, implicadas en una serie
amplia de procesos celulares tales como: regulación del ciclo celular, modulación
de los receptores de superficie y canales iónicos, procesamiento y presentación
de antígenos y activacion de factores de transcripción. Esta vía utiliza una
cascada enzimática, mediante la cual moléculas de ubiquitina se insertan
covalentemente a la proteína sustrato. Un paso importante en la cascada
proteolítica es el reconocimiento del sustrato por una de las muchas ubiquitina
ligasas, E3, lo cual conduce a la poliubiquitinación o señal de degradación. La
modificación por poliubiquitinación marca a la proteína para su destrucción y
la conduce al complejo proteosoma 26S para su degradación proteolítica.

DESTINO DE LOS
La mayoría de los AA se metabolizan en el hígado, donde el
exceso de NH4+ se excreta libre o se transforma hasta urea o ácido úrico para
su excrección, en dependencia de la especie animal. El amonio libre es tóxico,
por lo que el procedente de la degradación de AA en tejidos periféricos debe de
transportarse en formas no tóxicas hasta el hígado y en el hígado se transforma
en urea para su excrección. Se transporta hasta el hígado en forma de AA : ALA
y GLN, fundamentalmente.
CATABOLISMO
El catabolismo desintegra las moléculas en unidades más
pequeñas a través de una serie de reacciones químicas que liberan energía
durante este proceso.
El catabolismo es el encargado de crear la energía que
necesita el anabolismo para la síntesis de las hormonas, enzimas, azúcares y
las demás sustancias que producen el crecimiento celular, la reproducción y la
reparación de tejidos.
REMOCIÓN DEL GRUPO AMINO
La digestión de proteínas de la dieta comienza en el
estómago. La ingesta de proteínas estimula la síntesis de la hormona gastrina
que estimula la liberación de pepsinógeno, forma inactiva de la pépsina, una
endopeptida gástrica que produce fragmentos peptídicos. El proceso continua en
el intestino delgado por acción de las peptidasas pancreáticas: quimotripsina y
tripsina y otras enteropeptidasas. Los AA se absorben en los enterocitos del
intestino y se distribuyen por la sangre hasta los órganos y tejidos. La
degradación de AA excedentes supone que el grupo α-amino se convierta en urea
para su excreción, mientras que los esqueletos carbonados se transformen a
Acetil-CoA, piruvato o intermediarios del ciclo del Ac. Cítrico y la energía
consiguiente de su oxidación. La cadena carbonada de los AA podrá transformarse
finalmente en cuerpos cetónicos (AA cetogénicos) o glucosa (AA glucogénicos).
TRANSAMINACIONES
Son reacciones donde se traspasa el grupo amino desde un
α-aminoácido a un α-cetoácido, convirtiéndose el 1º enα-cetoácido, y el 2º en
un α-aminoácido. Las enzimas que catalizan estas reacciones son las
transaminasas y necesitan el piridoxal fosfato (PLP) como coenzima.

DESAMINACION
OXIDATIVA
El AA pierde el grupo amino y pasa a a-cetoácido. Esta
reacción reversible puede convertir el GLU en α-cetoglutarato para su degradación, pero también puede sintetizar GLU. Luego es una
reacción que actuará en sentido degradativo o en sentido biosintético según las
necesidades celulares.
CICLO DE LA GLUCOSA- ALANINA
 Es la serie de
reacciones en las que los grupos amino y los carbonos a partir de músculo son
transportados al hígado. Es muy similar a la ciclo de Cori en el ciclo de los
nutrientes entre el músculo esquelético y el hígado. Cuando los músculos se
degradan aminoácidos para las necesidades de energía, el nitrógeno resultante
se transaminado a piruvato para formar alanina . Esto se realiza por la enzima
alanina transaminasa (ALT), que convierte L- glutamato y piruvato en
α-cetoglutarato y L-alanina. La L-alanina resultante se transportó al hígado,
donde el nitrógeno entra en el ciclo de la urea y el piruvatose utiliza para
hacer la glucosa .
Es la serie de
reacciones en las que los grupos amino y los carbonos a partir de músculo son
transportados al hígado. Es muy similar a la ciclo de Cori en el ciclo de los
nutrientes entre el músculo esquelético y el hígado. Cuando los músculos se
degradan aminoácidos para las necesidades de energía, el nitrógeno resultante
se transaminado a piruvato para formar alanina . Esto se realiza por la enzima
alanina transaminasa (ALT), que convierte L- glutamato y piruvato en
α-cetoglutarato y L-alanina. La L-alanina resultante se transportó al hígado,
donde el nitrógeno entra en el ciclo de la urea y el piruvatose utiliza para
hacer la glucosa .
CICLO DE LA UREA
El ciclo de la urea es el proceso metabólico en el cual se
procesan los derivados proteicos y se genera urea como producto final. Si no se reutilizan para la síntesis de nuevos aminoácidos u
otros productos nitrogenados, los grupos amino se canalizan a un único producto
final de excreción. La mayoría de especies acuáticas, como por ejemplo los
peces óseos, excretan el nitrógeno amínico en forma de amoníaco por lo que se
les llama animales amonotélicos; la mayoría de animales terrestres son
ureotélicos, excretan el nitrógeno amínico en forma de urea; las aves y también
los reptiles son uricotélicos, excretan el nitrógeno amínico en forma de ácido
úrico.
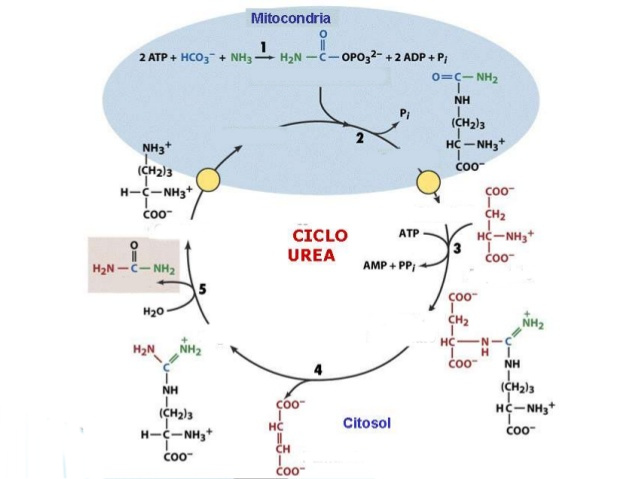
En los organismos ureotélicos, el amoníaco depositado en las
mitocondrias de los hepatocitos se convierte en urea mediante el ciclo de la
urea.
Reacciones:
1. El primer grupo
amino que ingresa al ciclo proviene del amoníaco libre intramitocondrial. El
amoníaco producido en las mitocondrias, se utiliza junto con el bicarbonato
(producto de la respiración celular), para producir carbamoil-fosfato. Reacción
dependiente de ATP y catalizada por la carbamoil-fosfato-sintetasa I. Enzima
alostérica y modulada (+) por el N-acetilglutamato.
2. El
carbamoil-fosfato cede su grupo carbamoilo a la ornitina, para formar citrulina
y liberar Pi. Reacción catalizada por la ornitina transcarbamoilasa. La citrulina
se libera al citoplasma.
3. El segundo grupo
amino procedente del aspartato (producido en la mitocondria por transaminación
y posteriormente exportado al citosol) se condensa con la citrulina para formar
argininosuccinato. Reacción catalizada por la argininosuccinato sintetasa
citoplasmática. Enzima que necesita ATP y produce como intermediario de la
reacción citrulil-AMP.
4. El
argininosuccinato se hidroliza por la arginino succinato liasa, para formar
arginina libre y fumarato.
5. El fumarato
ingresa en el ciclo de Krebs y la arginina libre se hidroliza en el citoplasma,
por la arginasa citoplasmática para formar urea y ornitina.
6. La ornitina puede
ser transportada a la mitocondria para iniciar otra vuelta del ciclo de la
urea.
En resumen, el ciclo de la urea consta de dos reacciones mitocondriales
y cuatro citoplasmática
REGULACIÓN DEL CICLO
El flujo del N a través del ciclo de la urea dependerá de la
composición de la dieta. Una dieta rica en proteínas aumentará la oxidación de
los aminoácidos, produciendo urea por el exceso de grupos aminos, al igual que
en una inanición severa.
Las cinco enzimas se sintetizan a velocidades más elevadas,
durante la inanición o en los animales con dieta rica en proteínas.
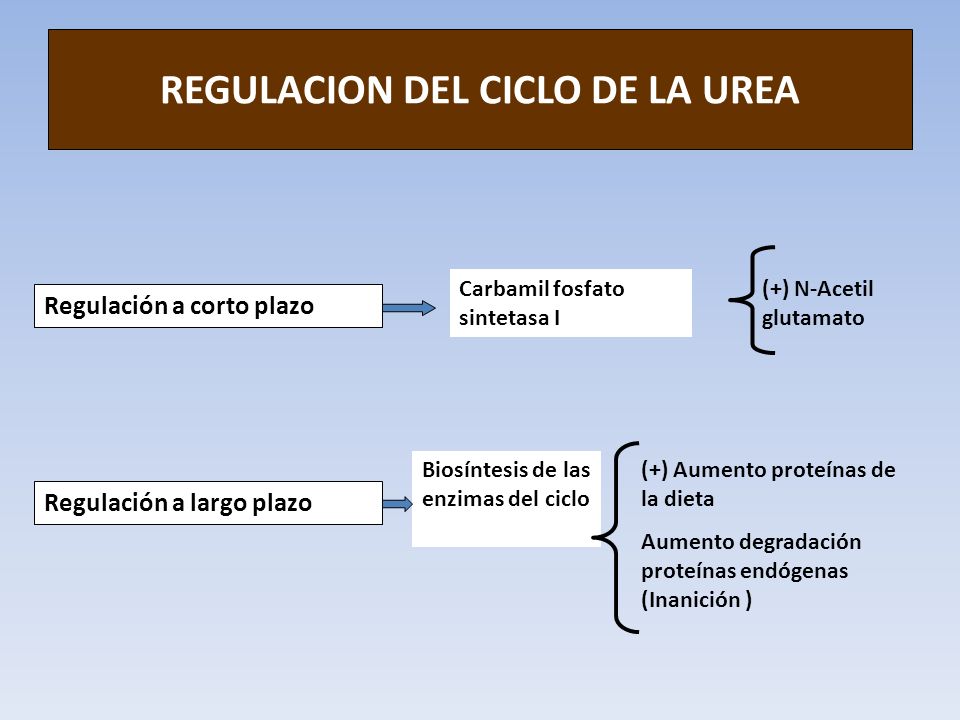
La enzima carbamoil-fosfato-sintetasa I es activada
alostéricamente por el N - acetilglutamato que se sintetiza a partir del
acetil-CoA y el glutamato, por la N-acetilglutamato sintetasa; enzima que, a su
vez, es activada por la arginina, aminoácido que se acumula cuando la
producción de urea es lenta.
Relación con el ciclo
de Krebs
Dado que el fumarato producido en la reacción de la
argininosuccinato liasa es también un intermediario del ciclo del ácido
cítrico, los ciclos están, en principio, interconectados –en un proceso
conocido como el “doble ciclo de Krebs”-. Sin embargo, cada ciclo puede
funcionar de manera independiente y la comunicación entre ellos depende del
transporte de intermedios clave entre la mitocondria y el citosol. Varias
enzimas del ciclo del ácido cítrico, incluyendo la fumarasa (fumarato hidratasa
y la malato deshidrogenasa) también están presentes como isozimas en el
citosol. El fumarato generado en la síntesis citosólica de arginina puede, por
tanto, convertirse en malato y a continuación en oxalacetato en el citosol, y
estos intermedios pueden seguir siendo metabolizados en el citosol o ser
transportados a las mitocondrias para su utilización en el ciclo del ácido
cítrico.
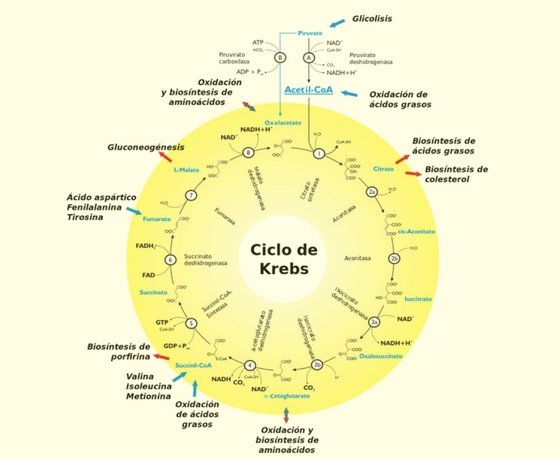
El aspartato formado en las mitocondrias por transaminación
entre oxalacetato y glutamato puede ser transportado al citosol, en donde actúa
como donador de nitrógeno en la reacción del ciclo de la urea catalizada por la
argininosuccinato sintetasa. Estas reacciones, que constituyen la desviación
del aspartato-argininosuccinato, proporcionan vínculos metabólicos entre las
rutas separadas por las que se procesan los grupos amino y los esqueletos
carbonados de los aminoácidos.
DESTINO DEL ESQUELETO
CARBONADO DE LOS AA
La cadena carbonada de los AA, una vez que han perdido el
grupo amino, puede seguir diferentes destinos metabólicos. Cuando su esqueleto
carbonado se transforme en metabolitos que puedan convertirse en glucosa, los
aminoácidos son denominados glucogénicos y cuando su cadena carbonada se
transforma en Acetil-CoA y cuerpos cetónicos, los AA son llamados cetogénicos.
Las cadenas carbonadas de algunos AA pueden derivar hacia ambos destinos.
Las cadenas carbonadas de los veinte AA se degradan hacia
tan sólo siete moléculas: piruvato, acetil-CoA, acetoacetil-CoA,
á-cetoglutarato, succinil-CoA, fumarato y oxalacetato. Los AA glucogénicos: se
degradan a piruvato, a-cetoglutarato, succinil-CoA, fumarato u oxalacetato;
luego por ello pueden ser precursores de la glucosa.
Los AA cetogénicos: se degradan a acetil-CoA o acetoacetato,
y de esta manera podrán convertirse en ácidos grasos o compuestos cetónicos. En
el esquema siguiente se recogen los destinos de los esqueletos carbonados de
todos los AA.
AMINOÁCIDOS GLUCOGENICOS
Los aminoácidos glucogénicos son los que dan lugar a una
producción neta de piruvato o intermediarios del Ciclo del TCA, tales como
α-cetoglutarato u oxaloacetato, que son precursores de la glucosa vía
gluconeogénesis. Todos los aminoácidos excepto la lisina y la leucina son al menos
en parte glucogénicos
AMINOACIDOS
CETOGENICOS
Son AA cetogénicos los que su esqueleto carbonado se degrada
a acetil-CoA o acetoacetato y pueden convertirse en ácidos grasos o cuerpos
cetónicos: Thr, Leu, Ile, Phe, Tyr, Trp y Lys.
SÍNTESIS DE PROTEINA
Se conoce como síntesis de proteínas al proceso por el cual
se componen nuevas proteínas a partir de los veinte aminoácidos esenciales. En
estre proceso, se transcribe el ADN en ARN. La síntesis de proteínas se realiza
en los ribosomas situados en el citoplasma celular.
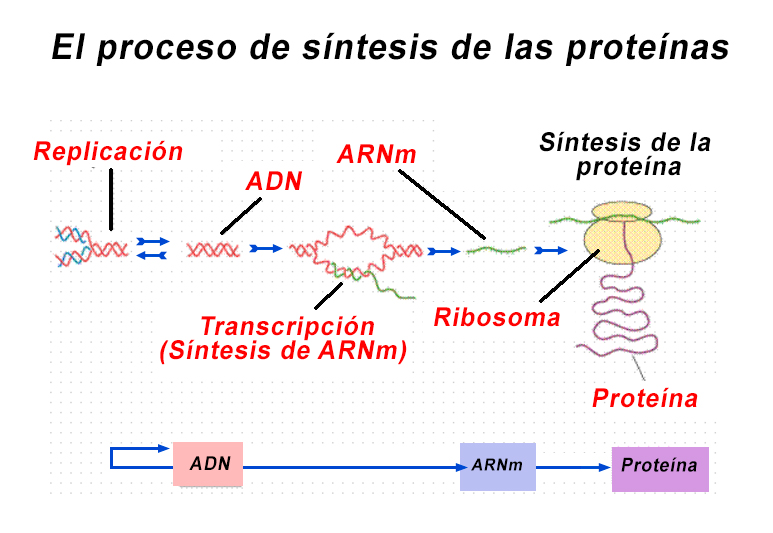
En el proceso de síntesis, los aminoácidos son transportados
por ARN de transferencia correspondiente para cada aminoácido hasta el ARN
mensajero donde se unen en la posición adecuada para formar las nuevas
proteínas.
Al finalizar la síntesis de una proteína, se libera el ARN
mensajero y puede volver a ser leido, incluso antes de que la síntesis de una
proteína termine, ya puede comenzar la siguiente, por lo cual, el mismo ARN
mensajero puede utilizarse por varios ribosomas al mismo tiempo.
SÍNTESIS DE AMINOÁCIDOS NO ESENCIALES
Se llama aminoácidos no esenciales a todos los aminoácidos
que el cuerpo puede sintetizar, y que no precisa de ingesta directa en una
dieta. En humanos se han descrito estos aminoácidos no esenciales
para la nutrición:
- Alanina
- Asparagina
- Aspartato
- Cisteina
- Glicina
- Glutamato
- Glutamina
- Hidroxilisina
- Hidroxiprolina
- Prolina
- Serina
- Tirosina
Algunas proteínas contienen aminoácidos hidroxilados. Los
más abundantes son la hidroxiprolina y la hidroxilisina, que se producen,
después de la síntesis de las cadenas polipeptídicas, a expensas de la prolina
y la lisina. Es decir, estos aminoácidos no son insertados como tales en la
cadena polipeptídica, y no tienen un código genético propio. Estos aminoácidos
son particularmente abundantes en el colágeno.
CONVERSIÓN DE LOS AMINOÁCIDOS EN PRODUCTOS ESPECIALIZADOS
Los aminoácidos son precursores de muchos compuestos que
contienen nitrógeno con funciones fisiológicas importantes Estas moléculas son
las porfirinas, los neurotransmisores, las hormonas, las purinas y las
pirimidinas.
Porfirinas
Porfirina al grupo prostético de las cromoproteínas
porfirínicas. Están compuestas por un anillo tetrapirrólico con sustituyentes
laterales y un átomo metálico en el centro, unido mediante cuatro enlaces de
coordinación. Se clasifican basándose en los sustituyentes laterales del
anillo, de modo que se distinguen meso porfirinas, uroporfirinas, etio
porfirinas y protoporfirinas. Estas últimas son las más relevantes. Presentan como
sustituyentes 4 metilos, 2 vinilos y 2 grupos propiónicos.
Existen 15 isómeros de protoporfirinas, pero en la
naturaleza solo aparece el IX, que se caracteriza por disponer cuatro grupos
metilo en posición 1,3,5 y 8, grupos vinilo en posición 2 y 4 y en posición 6 y
7 grupos propiónicos. A este grupo pertenecen la hemoglobina, la mioglobina y
los citocromos, entre otros
SISTESIS DEL HEMO
La hemoglobina es una proteína tetramérica: consta de dos
subunidades α y dos β, con notable homología entre ellas. Cada subunidad
contiene un grupo hemo (Fe Protoporfina IX).
En cada subunidad proteica del tetrámero, el grupo hemo
(grupo prostético) se halla encajado en la oquedad superior de la proteína
globular, manteniéndose unido a la proteína por el enlace tipo van der Waals
entre el átomo de hierro (Fe) y los nitrógenos imidazólicos (ver fórmula
bidimensional).
El grupo hemo tiene un comportamiento similar al de un
hidrocarburo aromático, manteniéndose en su posición por interacciones van der
Waals que ejercen los aminoácidos hidrofóbicos que lo rodean, a una distancia
estimada (estudios cristalográficos) de 0,4nm.
El átomo de hierro, en estado de spin elevado, sobresale del
plano del grupo hemo hacia el aminoácido histidina ubicado en posición F8.
La mioglobina es similar a la hemoglobina salvo que se trata
de una proteína monomérica; y, en consecuencia, solo tiene un grupo hemo.
Las funciones de la hemoglobina y mioglobina es el
transporte de oxígeno (O2), aquella en la sangre; y la mioglobina en el
músculo.
EJEMPLOS
Aminoácidos esenciales en la industria alimentaria
Reforzadores del sabor
Varios aminoácidos o sus derivados se utilizan como
reforzadores del sabor en comidas. Por ejemplo, la glicocola y la alanina se
utilizan para aumentar sabor y gusto. Otro ejemplo es el glutamato monosódico
(MSG), un derivado del ácido glutámico, ampliamente utilizado en los platos
asiáticos para intensificar el sabor.
Preservativos
Los aminoácidos son también de uso general como
preservativos en comida y bebida. Los zumos de fruta se preservan a menudo con
el uso de la cisteína como antioxidante.
El triptófano también se utiliza con histidina como un
antioxidante para preservar leche en polvo. La fenilalanina y el ácido
aspártico se combinan para producir el aspartamo del dipéptido. El aspartamo es
áspero 200 veces más dulces que la sucrosa y es de uso frecuente como opción
baja en calorías al edulcorante artificial en refrescos.
Valor alimenticio cada vez mayor
Algunos productos se complementan a menudo con ciertos
aminoácidos para aumentar su valor alimenticio. Muchos instalan productos basados
son deficientes en ciertos aminoácidos que se puedan introducir para proveer
del consumidor los alimentos extras para perfeccionar salud. Por ejemplo, el
pan se puede enriquecer con lisina, y los productos de la soja se pueden
enriquecer con metionina. La lisina, la metionina, y el ácido glutámico son
ampliamente utilizados en los piensos.
Aminoácidos en la industria química
Muchos aminoácidos se utilizan como precursores para las
substancias químicas usadas en diversas industrias, tales como pesticidas y
herbicidas. Por ejemplo, la treonina se puede utilizar para producir el
azthreonam del herbicida y la glicocola se puede utilizar para producir el
glicofosato, otro herbicida.
Aminoácidos en la industria de la aptitud física
Varios aminoácidos (leucina, valina, prolina, alanina,
cisteína, e isoleucina) se utilizan en los suplementos para el incremento y el
culturismo del músculo. El músculo del edificio implica el injerir de la
proteína y de los aminoácidos que acumulan las proteínas.

FUNCIONES
Función estructural: Los aminoácidos pueden formar parte de
proteínas que dan lugar a los tejidos propios de nuestro organismo, con una
funcionalidad de sostén y de relleno dentro te la estructura tisular. Además,
ciertas proteínas que forman estos tejidos de sostén, como puede ser la
elastina, dan propiedades elásticas a los tejidos. Por otro lado, estas
proteínas también pueden servir de armazones estructurales de componentes
celulares como los microtúbulos, que son considerados el “esqueleto” que
sostiene la estructura celular, o formando parte de la membrana plasmática, que
delimita el interior y el exterior celular.
Función reguladora de distintos procesos biológicos: Existen
distintas funciones reguladoras de las proteínas como la función enzimática, en
la que se acelera el proceso de las reacciones bioquímicas que tienen lugar en
nuestro cuerpo. La función reguladora de la homeostasis interna de nuestro
organismo, en la que ciertas proteínas de nuestro cuerpo regulan los distintos
procesos de ósmosis que tienen lugar en las membranas celulares. O también la
función reguladora de la división celular, mediante la proteína ciclina,
mecanismo muy importante a la hora de entender distintas enfermedades como el
cáncer.
Función defensiva: Muchas de las toxinas que son
perjudiciales para nuestro organismo, que son producidas por nuestro propio
cuerpo o provienen de otros seres vivos como animales y plantas a modo de
defensa frente a un invasor, tienen una estructura protéica. Es el caso por
ejemplo de los venenos de distintos animales. Por otro lado, existen proteínas
que forman parte de nuestro sistema inmunitario, que tienen una función
claramente defensiva frente a organismos patógenos como virus o bacterias.
Ejemplo de ello son los anticuerpos, que tienen una estructura proteica que son
capaces, en mucho de los casos, de neutralizar a bacterias y virus,
impidiéndoles el curso de la enfermedad infecciosa que pueden provocar.
Función de transporte: Muchas proteínas tienen la capacidad
de acoplarse a otras moléculas, facilitando su transporte a la largo de nuestro
cuerpo para su uso o degradación. Un modelo de proteína de transporte es la
hemoglobina, que es capaz de transportar oxígeno o dióxido de carbono por el
torrente sanguíneo para ser utilizados por la célula (oxígeno); o para su
eliminación, transportándolo a los alvéolos pulmonares (dióxido de carbono).
También existen otras proteínas transportadoras como los citocromos cuya
función es la de transportar energía química en las células vivas, ya sean
animales (en el proceso de respiración), o en vegetales durante la
fotosíntesis.
Función de contracción: Los aminoácidos también forman parte
de proteínas musculares involucradas en la contracción. Dentro de estas
proteínas destacan la miosina y la actina, que forman parte de las fibras
contráctiles de los músculos. Gracias a ellas, como se puede estudiar en el
Máster de Entrenador Personal Online, es posible la contracción muscular y por
tanto el movimiento de extremidades, así como, el movimiento de contracción y
relajación de nuestro corazón, o los movimientos intestinales, esenciales para
un correcto procesado de los alimentos durante la digestión.
Función de reserva energética: cuando nuestro organismo lo
necesita, puede utilizar las proteínas para obtener energía. Esto ocurre cuando
las reservas de grasas se agotan y es necesario degradar las proteínas para
obtener energía química para seguir realizando los procesos vitales básicos,
manteniendo las funciones fisiológicas básicas de nuestro cuerpo.
Elaborado por:
Alberto Padrino
Marlene Diaz




No hay comentarios:
Publicar un comentario